
Mancini, Estefanía
Centro de Regulación Genómica, Barcelona, España.
Zadra, Giorgia
Institute of Molecular Genetics, National Research Council, Pavia, Italy.
En las células tumorales se observa una reprogramación de su metabolismo hacia la síntesis de distintas biomoléculas necesarias para la duplicación celular. Entre las vías metabólicas exacerbadas en células tumorales se encuentra la síntesis de ácidos grasos, componentes esenciales para la producción de fosfolípidos de membrana.
Trabajos previos de nuestro y otros laboratorios han mostrado la importancia de la síntesis de novo de ácidos grasos para la proliferación celular y su uso potencial como blanco terapéutico en numerosos cánceres.
Se desconoce, sin embargo, por qué las células requieren de esta vía aún en presencia de ácidos grasos exógenos. Existe evidencia de que esta ruta metabólica también está vinculada a la proliferación en células normales de mamíferos y en levaduras, lo cual sugiere que es un requerimiento general para la proliferación celular. Las células normales, sin embargo, son menos sensibles al efecto de la inhibición de la síntesis de novo de ácidos grasos, lo que puede proveer de una ventana terapéutica.
El objetivo general de nuestra línea de trabajo es contribuir al conocimiento de la función y regulación del metabolismo de ácidos grasos y fosfolípidos de membrana en la proliferación celular. Actualmente, estamos estudiando la canalización de ácidos grasos hacia diversas rutas metabólicas utilizando células en cultivo, ratones y herramientas bioinformáticas. Particularmente, estamos estudiando el rol de proteínas que unen ácidos grasos (FABP1 y 5) en la reprogramación del metabolismo de cáncer colorectal y adenocarcinoma de pulmón.
El fin último del trabajo es aplicar estos conocimientos para evaluar posibles blancos terapéuticos nuevos así como su uso para el diagnóstico y seguimiento en enfermedades hiperproliferativas, como el cáncer
Fatty acid binding protein 1 (FABP1) depletion promotes an oxidative metabolic shift in Caco-2 colorectal cancer cells.
Borús, Delfina Lucía; Zadra, Giorgia; Minsky, Daniel; Costa, María Lucía; Córsico, Betina; Storch, Judith; Scaglia, Natalia
2025. ELSEVIER SCIENCE BV.
DOI: 10.1016/j.bbalip.2025.159661
Fatty acid binding protein 5 regulates lipogenesis and tumor growth in lung adenocarcinoma.
García, Karina Andrea; Costa, María Lucía; Lacunza, Ezequiel; Martínez, María Elizabeth; Corsico, Betina; Scaglia, Natalia.
2022. Life sciences. PERGAMON-ELSEVIER SCIENCE LTD. vol. 301, ISSN 0024-3205
DOI: 10.1016/j.lfs.2022.120621
Prostate Cancer Progression: as a Matter of Fats.
Scaglia, Natalia; Frontini-López, Yesica Romina; Zadra, Giorgia.
2021. Frontiers in oncology: Frontiers Media S.A. DOI: 10.3389/fonc.2021.719865
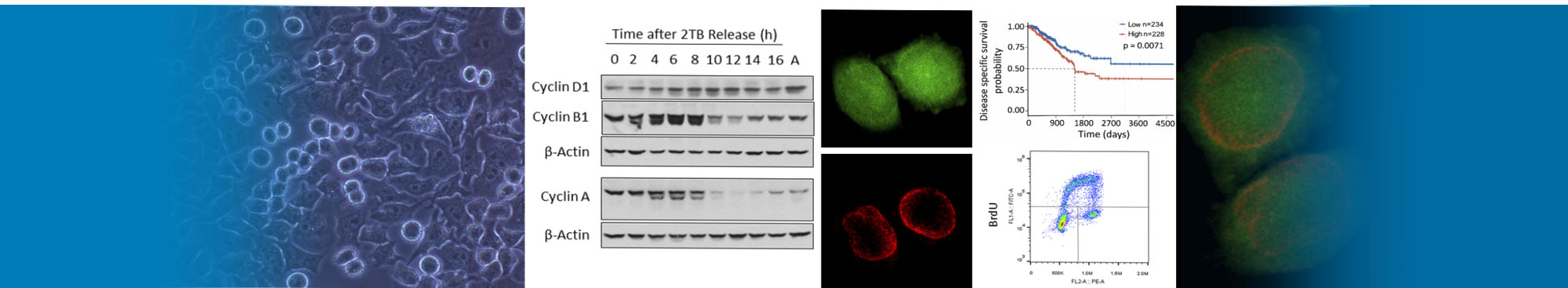
De novo lipogénesis at the mitotic exit is used for nuclear envelope reassembly/expansion. Implications for combined chemotherapy.
Rodríguez Sawicki, Luciana; García, Karina A.; Córsico, Betina; Scaglia, Natalia.
2019: Cell cycle. Austin, Texas: LANDES BIOSCIENCE, p. 1646-1659. ISSN 1538-4101
doi.org/10.1080/15384101.2019.1629792
FABP1 knockdown in human enterocytes impairs proliferation and alters lipid metabolism.
Rodriguez Sawicki, L; Bottasso Arias, N. M; Scaglia, N; Falomir Lockhart, L; Franchini, G. R; Storch, J; Córsico, B.
2017. Biochimica et biophysica acta-molecular and cell biology of lipids. ELSEVIER SCIENCE BV. vol. 1862, n° 12, p. 1587-1594. ISSN 1388-1981
Analysis of triglyceride synthesis unveils a green algal soluble diacylglycerol acyltransferase and provides clues to potential enzymatic components of the chloroplast pathway.
Bagnato, C; Prados, M. B; Franchini, G. R; Scaglia, N; Miranda, S. E; Beligni, M. V.
2017. Bmc genomics: BIOMED CENTRAL LTD. vol. 18, n° 1, ISSN 1471-2164
A novel direct activator of AMPK inhibits prostate cancer growth by blocking lipogenesis.
Zadra, G; Photopoulos, C; Tyekucheva, S; Heidari, P; Weng, Q. P; Fedele, G; Liu, H; Scaglia, N; Priolo, C; Sicinska, E; Mahmood, U; Signoretti, S; Birnberg, N; Loda, M.
2014. Embo Molecular Medicine. Londres: WILEY-BLACKWELL PUBLISHING, INC,. vol. 6, p. 519-538. ISSN 1757-4676
AKT1 and MYC Induce Distinctive Metabolic Fingerprints in Human Prostate Cancer.
.
Priolo, C; Pyne, S; Rose, J; Regan, E. R; Zadra, G; Photopoulos, C; Cacciatore, S; Schulz, D; Scaglia, N; Mcdunn, J; De Marzo, A. M; Loda, M.
2014. Cancer Research. Philadelphia: AMER ASSOC CANCER RESEARCH,. vol. 74, n° 24, p. 7198-7204. ISSN 0008-5472
De novo fatty acid synthesis at the mitotic exit is required to complete cellular division.
Scaglia, N; Tyekucheva, S; Zadra, G; Photopoulos, C; Loda, M.
2014. Cell Cycle. Austin, Texas: LANDES BIOSCIENCE,. vol. 13, p. 859-868. ISSN 1538-4101
Inhibition of Stearoyl-CoA Desaturase 1 inactivates Acetyl-CoA Carboxylase and impairs proliferation in cancer cells: role of AMPK.
Scaglia, N; Chisholm, J. W; Igal, R. A.
2009. PLoS One. 4(8): e6812
Regulation of fatty acid synthesis and desaturation in senescence of human fibroblasts.
Maeda, M; Scaglia, N; Igal, R. A.
2009. Life Sci. 84:119-124
Inhibition of Stearoyl-CoA Desaturase 1 expression in human lung adenocarcinoma cells impairs tumorigenesis.
Scaglia, N., Igal, R. A.
2008. Int J Oncol. 33(4):839-50
Stearoyl-CoA desaturase is involved in the control of proliferation, anchorage-independent growth, and survival in human transformed cells.
Scaglia, N; Igal, R. A.
2005. J Biol Chem. 280(27):25339-49
High stearoyl-CoA desaturase protein and activity levels in simian virus 40 transformed-human lung fibroblasts.
Scaglia, N; Caviglia, J. M; Igal, R. A.
2005.Biochim Biophys Acta, 1687(1-3):141-51
Análisis estructural y funcional de macromoléculas.
Córsico, B; Falomir-Lockhart, L. J; Franchini, G. R; Scaglia, N.
2013. La Plata. Libro de Catedra. Edulp, p. 422. ISBN 978-950-34-1057-8
sedici.unlp.edu.ar/handle/10915/37269